
L'importance de la température dans l'industrie pharmaceutique
Prescriptions
L’organisation mondiale de la santé (OMS) développe des normes et standards internationaux pour le contrôle des produits sanitaires et pour l’exclusion des produits non conformes. Mais les fabricants de produits pharmaceutiques doivent-ils se conformer aux normes de l’OMS ?
Le Conseil international pour l’harmonisation des exigences techniques concernant les produits pharmaceutiques à usage humain (ICH) regroupe les agences gouvernementales et les entreprises pharmaceutiques et développe les directives ICH appliquées par les autorités chargées de la réglementation. Une autorité réglementaire est l’autorité publique ou gouvernementale qui élabore les règles et les prescriptions pour un secteur spécifique d’application, chaque pays ayant sa propre autorité réglementaire et donc ses propres règles et spécifications.
Les autorités les plus connues sont la Food and Drug Administration américaine (FDA) et EudraLex, la législation européenne qui détermine qui a le droit de fabriquer, de stocker et de distribuer des produits médicaux. Les produits médicaux peuvent être fabriqués dans un pays et importés dans un autre : ces produits sont soumis à la législation du pays importateur. Il est donc logique que toutes les autorités de contrôle coordonnent leurs actions.
Étant donné que les règlements officiels laissent une marge d’interprétation, des organisations ont été créées pour veiller que toutes les entreprises soumises à la régulation comprennent et respectent ces règlements :
- La Société internationale d’ingénierie pharmaceutique (ISPE),
- La pharmacopée américaine (US Pharmacopeia, USP),
- L’organisation mondiale de la santé (OMS)
L’Organisation internationale de normalisation (ISO) est une organisation internationale indépendante qui établit des normes internationales. Les normes sont facultatives et non obligatoires, mais les autorités réglementaires peuvent utiliser les normes pour renforcer les prescriptions techniques.
Par conséquent : non, les entreprises pharmaceutiques ne sont pas tenues de se conformer aux normes et standards de l’OMS lorsqu’elles commercialisent des produits pharmaceutiques. L’entreprise soumise à la réglementation doit se conformer aux règles établies par les autorités locales et peut utiliser les normes et standards de l’OMS pour assurer sa conformité.
La température détermine la qualité du produit
Lorsque des produits sont exposés à une température inadéquate, leur qualité ne peut plus être garantie. Ceci est encore plus important pour les industries pharmaceutiques, cosmétiques et alimentaires puisque la vie des consommateurs peut être menacée par les effets de la température sur les produits et leurs composants, tels que la dégradation, l’altération de l’efficacité et du goût et la détérioration.
Dans l’industrie pharmaceutique, des réglementations ont été établies pour protéger les patients et fournir des produits sûrs et efficaces avec une qualité garantie. Dans le cadre de l’évaluation des risques des produits, la gamme de température requise est définie, entre autres paramètres, afin de garantir leur qualité.
Que sont les produits pharmaceutiques:
Médicaments, médications, vaccins, principes pharmaceutiques actifs (API), échantillons de tissus, produits biopharmaceutiques, dispositifs médicaux, ...
Applications
Vous trouverez ci-dessous un aperçu des applications pour lesquelles le contrôle de la température est d’une importance cruciale :
- Contrôle cryogénique.
- Contrôle de températures extrêmement basses (y compris avec de la glace carbonique).
- Contrôle des appareils de réfrigération et de congélation.
- Contrôle de stabilité.
- Surveillance d’incubateurs
- Contrôle de greniers.
- Contrôle d’entrepôts.
- Contrôle de centres de distribution.
- Contrôle de salles blanches
- Surveillance pendant le transport (camions, avions, containers, trains, etc.)
- Surveillance de points de vente du secteur sanitaire (pharmacies, vétérinaires, dentistes, hôpitaux, etc.)
- Surveillance des banques de sang
- Surveillance des banques de tissus cellulaires
- Surveillance des biobanques
- Surveillance des laboratoires d’étalonnage
Lignes directices de la qualité
Les directives GxP pour la qualité, développées par les autorités réglementaires ont été conçues afin de couvrir la qualité du produit tout au long de son cycle de vie.

Pour débuter la phase de développement des médicaments :

Une fois la phase de R&D terminée et le produit pharmaceutique homologué par les autorités réglementaires, la production est démarrée et le médicament est mis à disposition des patients.

Les bonnes pratiques de laboratoire (Good Laboratory Practice, GLP) : définissent un ensemble de règles et critères pour un système de qualité pour les processus et conditions organisationnels, dans lesquels les études de sécurité non cliniques sur la santé et l’environnement sont planifiées, réalisées, contrôlées, enregistrées, rapportées et archivées.
Les bonnes pratiques de distribution (Good Distribution Practice, GDP) : décrivent les normes minimales qui doivent être respectées pour garantir que la qualité et l’intégrité des médicaments sont maintenues tout au long de la chaîne de livraison. Les GDP sont valables pour l’achat, le stockage et le transport de principes actifs pharmaceutiques et autres composants utilisés pour la fabrication de médicaments.
Les bonnes pratiques de fabrication (Good Manufacturing Practice, GMP) : décrivent les normes minimales qu’un fabricant de médicaments doit respecter dans le cadre de son processus de fabrication. Pour l’exemple des GMP, les lignes directrices de la FDA et de l’UE sont précisées ci-dessous : For the example of GMP, here are the guidelines from the FDA and EU:
- FDA 21 CFR partie 210 : bonnes pratiques de fabrication actuelles pour le processus de fabrication, le conditionnement ou le stockage des médicaments.
- FDA 21 CFR partie 211 : Bonnes pratiques de fabrication actuelles pour les produits pharmaceutiques finis.
- EudraLex – volume 4 – directives pour les bonnes pratiques de fabrication (GMP).
Respect des directive GXP
Les directives GxP stipulent que la zone doit être homologuée, que la température doit être contrôlée et que les appareils de contrôle doivent être étalonnés pour respecter les directives.
Zone homologuée : l’homologation de la zone est un processus dans lequel il est prouvé que la zone répond aux exigences prévues pour son usage.
Température contrôlée : les paramètres critiques (entre autres la température) doivent être mesurés et enregistrés pour un usage ultérieur (certaines fois jusqu’à 18 ans ou plus)
Appareils étalonnés: Les appareils utilisés pour le contrôle doivent afficher les valeurs correctes. Les appareils doivent être étalonnés régulièrement afin de garantir que les mesures fournissent toujours des valeurs correctes.
Les règles n’indiquent pas comment les directives doivent être respectées, l’utilisateur peut donc déterminer comment la zone doit être homologuée et contrôlée et à quelle fréquence les appareils doivent être étalonnés.
LE TRAVAIL AVEC LES DIRECTIVES GxP
Lorsqu’un système de monitoring est installé, les données saisies doivent être évaluées afin de garantir que la température est en permanence située dans la fourchette des valeurs limites spécifiées.
Lorsqu’un système autonome est utilisé, aucune donnée n’est fournie en direct, c’est-à-dire que les écarts éventuels de température ne sont détectés que lors du téléchargement des données.
Avec un système de monitoring en continu, l’utilisateur est alerté par courriel, texto ou appel téléphonique dès qu’une valeur limite est franchie et peut donc agir ou réagir en conséquence. Il sait exactement l’endroit et le moment où l’alarme s’est déclenchée, depuis combien de temps elle est en vigueur et quelles sont les personnes qui l’ont vue.
Le rapport d’audit du système de monitoring continu permet aux utilisateurs et aux contrôleurs de suivre un secteur et de se rendre compte exactement de ce qui s’est passé et quand toutes les informations des utilisateurs ont été enregistrées dans le système. Ceci permet de déterminer les procédures opérationnelles standards (POS) qui ont été appliquées et les mesures correctives et préventives nécessaires.
Un écart de température signifie dans tous les cas que des mesures doivent être prises !
INFRACTIONS
Si un rapport d’audit est effectué et que les exigences réglementaires ne sont pas respectées, une infraction est documentée. Le formulaire 483 de la FDA « Notification des commentaires d’inspection » comprend une infraction documentée à la suite d’un audit de la FDA. Les données sont accessibles au public dès qu’une entreprise a reçu le formulaire 483. Plus de 155 manquements dans le contrôle de l’environnement (principalement liés à la température) ont été relevés et documentés en 2019 dans les secteurs des médicaments, des produits pharmaceutiques et médicaux, des transplantations de tissus humains, de la médecine vétérinaire et des préparations biologiques.

ENVIRONNEMENTS SOUS CONTRÔLE
La conception du dispositif de gestion des bâtiments (SGB) est un élément essentiel lors de la planification d’un système. Le SBG gère toutes les fonctions dans un système, y compris le chauffage, l’aération et la climatisation (CAC) du bâtiment, à l’aide de capteurs répartis sur tout le dispositif. Un système de monitoring de l’environnement (EMS) peut être installé afin de garantir que le SBG commande de manière correcte les appareils de CAC. Le SME surveille tous les paramètres de contrôle critiques définis lors de l’évaluation des risques du produit, qui ont été définis lors de la qualification du système. 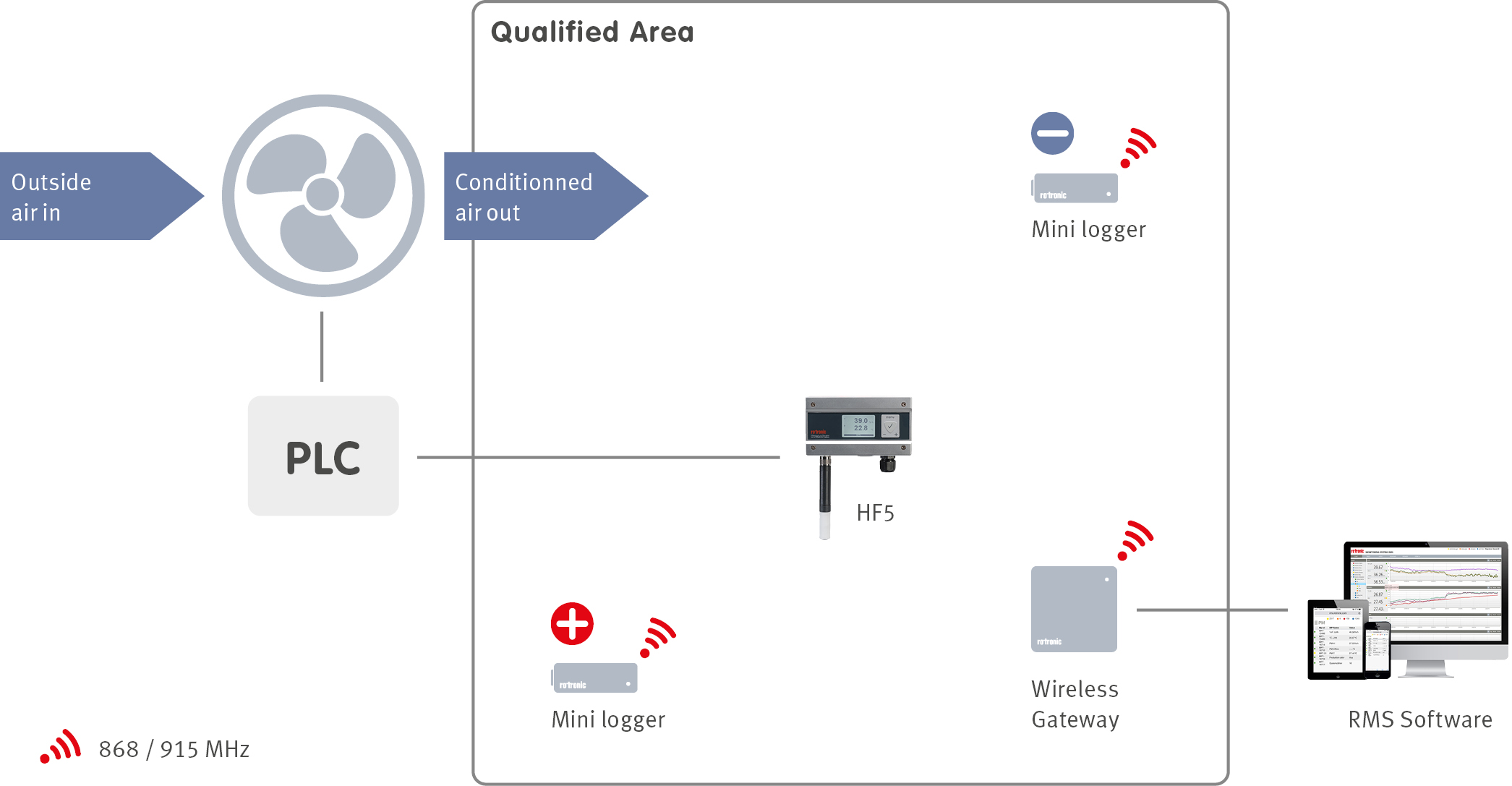
Dans les environnements sous contrôle, la température est également contrôlée pendant les phases de R&D ainsi que dans les applications de transport et d’entreposage. De plus, le monitoring est nécessaire pour s’assurer que le contrôle de la température est effectué correctement !
HOMOLOGATION DES ZONES
L’homologation de la zone doit démontrer, sur la base de preuves scientifiques, que la zone est adaptée à l’usage prévu.
Les directives relatives au conditionnement et à l’entreposage USP 659 contiennent des définitions relatives aux conditions de stockage pour l’entreposage et la distribution de principes actifs, excipients et produits médicaux ainsi que de médicaments, de dispositifs médicaux, produits de combinaison et de compléments alimentaires. Des instructions spécifiques concernant les conditions de stockage (température ou humidité) dans lesquelles un article doit être stocké et expédié (sur la base d’études de stabilité) doivent être fournies pour tous les produits.
Les définitions suivantes sont valables pour la température et le stockage des médicaments :
- Chambre de congélation : -25…-10 °C.
- Réfrigérateurs : 2…8 °C.
- Froid : 8 °C.
- Frais : 8…15 °C.
- Température ambiante : la température dans un environnement de travail.
- Température ambiante contrôlée : 20…25 °C. La température cinétique moyenne ne devrait pas dépasser 25 °C, les écarts entre 15 et 30 °C sont toutefois tolérés, des pointes temporaires jusqu’à 40°C sont également tolérées à condition qu’elles ne dépassent pas une durée de 24 heures. Des pics de plus de 40 °C sont admissibles si elles sont autorisées par le fabricant.
- Que signifie la température cinétique moyenne ?
- Chaud : 30…40 °C.
- Chaleur excessive : >40 °C.
- Endroit sec : humidité relative moyenne de >40 % à 20 °C.
- Protéger du gel.
- Protéger de la lumière
QUE SIGNIFIE TEMPÉRATURE CINÉTIQUE MOYENNE ?
La température cinétique moyenne est l’effet total de la température sur un objet ou un produit pendant une période donnée.
Extrait de la partie Q 1 A (R2) de la CIH : test de stabilité des nouveaux médicaments et produits :
Température cinétique moyenne : un écart de température isolé qui, lorsqu’il est maintenu pendant une certaine période, présente le même degré thermique que les fluctuations de température vers le haut et vers le bas sur une période de temps définie équivalente. La température cinétique moyenne est plus haute que la température arithmétique moyenne et prend, de plus, en compte l’équation d’Arrhenius. Pour s’assurer que toute la pièce est régulée dans la gamme de température spécifiée, une cartographie de température est établie dès que l’application de la zone a été définie. Cette cartographie permet de définir les points chauds et froids de la zone, qui doivent ensuite être surveillés.
Il est précisé dans le supplément 8 de l’OMS « Cartographie de température des zones de stockage », comment un processus systématique de cartographie est effectué pour une zone soumise au contrôle de la température. L’USP 1079 contient également des lignes directrices pour la cartographie des températures.
Il est précisé dans le supplément 8 de l’OMS « Cartographie de température des zones de stockage », comment un processus systématique de cartographie est effectué pour une zone soumise au contrôle de la température.
L’USP 1079 contient également des lignes directrices pour la cartographie des températures.
Rotronic propose des appareils pour la cartographie, des équipements en location et des prestations complètes de cartographie.
INSTALLATION D’UN SYSTÈME DE MONITORING
L’analyse des risques sert à définir quel type de monitoring est nécessaire. Pour cela, l’ISPE a publié les lignes directrices GAMP5 « Systèmes informatisés conformes à GxP » qui sont destinées à aider les utilisateurs soumis à la réglementation dans l’élaboration d’une solution appropriée pour le respect des directives GxP.
Rotronic propose les loggers électroniques de données suivants pour le monitoring :
- HL-1D (monitoring autonome)
- HL-20D (monitoring autonome)
- RMS-MLOG (monitoring continu par radio)
- RMS-LOG (monitoring continu par radio et liaisons par câbles)
Si le monitoring est de type numérique, le système de contrôle doit être conforme à la norme 21 CFR partie 11 de la FDA et à l’annexe 11 de l’UE.
Rotronic propose les solutions logicielles GAMP5 de catégorie 4 suivantes, conformes à la réglementation relative aux applications de monitoring :
- HW4 (monitoring autonome)
- RMS (monitoring continu)
LES AVANTAGES DU RMS EN UN COUP D’ŒIL.
1) Conforme à la FDA 21 CFR partie 11/EU annexe 11 conçu sur la base des directives GAMP5.
2) Monitoring continu.
3) Alarmes par courriel, texto et téléphone.
4) Prêt à l’emploi rapidement et facilement.
Le système de surveillance (autonome ou continu) doit être validé pour garantir sa compatibilité avec l’objectif visé, sur la base de l’approche fondée sur les risques, conformément aux directives GAMP5 concernant les systèmes informatisés conformes aux GxP.
CHOIX DES APPAREILS
USP 1118 « Appareils de monitoring – temps, température et humidité » donne un aperçu des appareils de mesure qui peuvent être utilisés et énumère les différentes technologies.
Rotronic utilise les technologies suivantes pour les loggers électroniques de données radio ou reliés par câble :
Capteurs de température :
Capteurs pour l’humidité relative :
ÉTALONNAGE DES APPAREILS
TLes appareils Rotronic peuvent être étalonnés grâce à leur écran ou avec le logiciel correspondant. Rotronic propose une série d’appareils d’étalonnage pour la température et l’humidité relative :
- Solutions salées EAxx-SCS (fournies avec un certificat d’étalonnage ISO-17025)
- Générateur d’humidité HygroCal100
- Générateur d’humidité et de température HG2-S
- Générateur d’humidité et de température HG2-XL
- Appareil de référence à miroir refroidi S8000
RMS features a calibration management tool, where all historical calibrations are documented and reminders for upcoming calibrations are communicated. Rotronic also offer calibration services:
- Étalonnages sur site.
- Étalonnages ISO 9001.
- Étalonnages ISO 17025.
FORMATION
Rotronic propose des formations pour le matériel et les logiciels afin de garantir que les utilisateurs puissent utiliser toute la puissance de nos solutions pour les applications GxP.
PRESTATIONS
Rotronic assure le support de ses clients avec les prestations suivantes
Des questions? Contactez-nous !
Le WB-0001 détecte la présence d’eau ou de liquide conducteur. Petit, économique et flexible. Petit, économique et flexible. Le RMS-LOG-T30 est un logger de données équipé de deux convertisseurs analogique/numérique intégrés, auxquels il est possible de connecter deux éléments sensibles PT100, pour des mesures de température hautement précise. Le RMS-LOG-T30 est un logger de données équipé de deux convertisseurs analogique/numérique intégrés, auxquels il est possible de connecter deux éléments sensibles PT100, pour des mesures de température hautement précise. Le RMS-LOG-T30 est un logger de données équipé de deux convertisseurs analogique/numérique intégrés, auxquels il est possible de connecter deux éléments sensibles PT100, pour des mesures de température hautement précise. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Les éléments sensibles de température T10 sont des thermistors NTC (NTC = coefficient négatif de température); cela signifie que la résistance NTC diminue lorsque la température augmente. Petit, économique et flexible. Petit, économique et flexible. Petit, économique et flexible.Recommended Products
WB-0001
RMS-MLOG-B-915 - Logger de données mini sans fil - Température et humidité
RMS-MLOG-B-915 - Logger de données mini sans fil - Température et humidité
RMS-LOG-T30-868
RMS-LOG-T30-915
RMS-LOG-T30-L - Loggers de Données
AC1207
RMS T10-0113
RMS T10-0013
RMS T10-0006
RMS T10-0005
RMS T10-0004
RMS T10-0003
RMS T10-0002
RMS T10-0001
RMS-MLOG-T10-868 - Logger de données mini sans fil - Température avec capteur externe (NTC)
RMS-MLOG-T10-915 - Logger de données mini sans fil - Température avec capteur externe (NTC)
RMS-MLOG-T-868 - Logger de données mini sans fil - Température






















