
Die Bedeutung der Temperatur in der Pharmaindustrie
Vorschriften
Die Weltgesundheitsorganisation (WHO) entwickelt internationale Normen und Standards zur Kontrolle von Gesundheitsprodukten und zum Ausschluss von minderwertigen Arzneimitteln - aber müssen sich Pharmahersteller an die WHO-Normen halten?
Der International Council for Harmonisation for Technical Requirements for Pharmaceuticals for Human Use (ICH) bringt Regierungsbehörden und Pharmaunternehmen zusammen und entwickelt ICH-Richtlinien, die von den Aufsichtsbehörden angewendet werden. Eine Aufsichtsbehörde ist die zuständige öffentliche oder Regierungsbehörde, die Regeln und Vorschriften für einen bestimmten Anwendungbereich erlässt, wobei jedes Land eine eigene Aufsichtsbehörde und damit auch eigene Regeln und Vorschriften hat.
Die bekanntesten Behörden sind die US Food and Drug Administration (FDA) und EudraLex – die EU-Gesetzgebung, die festlegen, wer Medizinprodukte herstellen, lagern und vertreiben darf. Medizinprodukte können in einem Land hergestellt und in ein anderes importiert werden: Diese Produkte unterstehen der Behörde des Importlands. Es ist daher sinnvoll, dass sich alle Aufsichtsbehörden abstimmen.
Da die offiziellen Vorschriften jedoch Raum zur Interpretation lassen, wurden Organisationen geschaffen, die sicherstellen sollen, dass alle regulierten Unternehmen die Vorschriften verstehen und einhalten:
- Die International Society for Pharmaceutical Engineering (ISPE),
- Das US-Arzneibuch (US Pharmacopeia, USP),
- Die Weltgesundheitsorganisation (WHO).
Die International Organisation for Standardization (ISO) ist eine unabhängige, internationale Organisation, die internationale Standards entwickelt. Standards sind freiwillig und nicht obligatorisch, Aufsichtsbehörden können jedoch Standards verwenden, um technische Vorschriften zu unterstützen.
Daher: Nein, Pharmaunternehmen müssen sich beim Handel mit pharmazeutischen Produkten nicht an die WHO-Normen und Standards halten. Das regulierte Unternehmen muss die von den lokalen Aufsichtsbehörden erlassenen Vorschriften einhalten und kann die WHO-Normen und Standards nutzen, um die Einhaltung der Vorschriften zu unterstützen.
Temperatur bestimmt die Produktvitität
Werden bestimmte Produkte falschen Temperaturen ausgesetzt, ist die Produktqualität nicht mehr gewährleistet. In der pharmazeutischen, kosmezeutischen und Nahrungsmittelindustrie ist dies sogar noch wichtiger, da das Leben von Verbrauchern aufgrund von Temperatureffekten auf Produkte/Inhaltsstoffe, wie Zersetzung, beeinträchtigte Wirkung/Geschmack und Verderben, in Gefahr geraten kann.
In der Pharmaindustrie wurden Vorschriften erlassen, um die Patienten zu schützen und sichere und wirksame Produkte mit gesicherter Qualität zu liefern. Im Rahmen der Produkt-Risikobetrachtung wird, neben anderen Parametern, der Temperaturbereich definiert, der zur Gewähr der Produktqualität erforderlich ist.
Was sind pharmazeutische Produkte:
Arzneimittel, Medikamente, Impfstoffe, Pharmawirkstoffe (API), Gewebeproben, Biopharmazeutika, Medizinprodukte, ...
Anwendungen
Nachstehend finden Sie einen Überblick über die Anwendungen, in denen die Temperaturüberwachung von entscheidender Bedeutung ist:
- Kryogenische Überwachung.
- Überwachung von extrem niedrigen Temperaturen (darunter auch mit Trockeneis).
- Kühl- und Gefriergeräte-Überwachung.
- Stabilitätsprüfung.
- Inkubator-Überwachung.
- Speicher-Überwachung.
- Lager-Überwachung.
- Überwachung von Verteilzentren
- Reinraum-Überwachung
- Transport-Überwachung (Lastwagen, Flugzeuge, Cointainer, Züge, …)
- Überwachung von Verkaufsstellen im Gesundheitswesen (Apotheken, Tierärzte, Zahnärzte, Krankenhäuser, …)
- Blutbank-Überwachung
- Gewebebank-Überwachung
- Biobank-Überwachung
- Überwachung von Kalibrierlabors
Qualitätsrichtlinien
Die von den Aufsichtsbehörden entwickelten GxP-Qualitätsrichtlinien wurden konzipiert, um die Produktqualität über den gesamten Lebenszyklus des Produkts abzudecken.

Zu Beginn der Entwicklungsphase neuer Medikamente:

Sobald die F&E-Phase abgeschlossen ist und das pharmazeutische Produkt von der Aufsichtsbehörde zugelassen wurde, wird die Produktion hochgefahren und das Medikament den Patienten zur Verfügung gestellt.

Gute Laborpraxis (Good Laboratory Practice, GLP): Definiert ein Regelwerk und Kriterien für ein Qualitätssystem für organisatorische Prozesse und Bedingungen, unter denen nicht klinische Gesundheits- und Umweltsicherheitsstudien geplant, durchgeführt, überwacht, aufgezeichnet, gemeldet und archiviert werden.
Gute Vertriebspraxis (Good Distribution Practice, GDP): Beschreibt die Mindeststandards, die erfüllt werden müssen, um zu gewährleisten, dass die Qualität und die Integrität von Medikamenten über die gesamte Lieferkette hinweg aufrecht erhalten wird. GDP gilt für die Beschaffung, die Lagerung und den Transport von Pharmawirkstoffen und anderen Inhaltsstoffen, die bei der Herstellung von Medikamenten eingesetzt werden.
Gute Herstellungspraxis (Good Manufacturing Practice, GMP): Beschreibt die Mindeststandards, die ein Arzneimittelhersteller im Rahmen seiner Herstellungsprozesse einhalten muss. Für das Beispiel GMP sind nachstehend die Richtlinien der FDA und der EU aufgeführt:
- FDA 21 CFR Part 210: Aktuelle gute Herstellungspraxis für den Herstellungsprozess, die Verpackung oder die Aufbewahrung von Arzneimitteln.
- FDA 21 CFR Part 211: Aktuelle gute Herstellungspraxis für fertige Pharmazeutika.
- EudraLex – Band 4 – Richtlinien für die gute Herstellungspraxis (GMP).
Einhaltung der GXP-Richtlinien
Die GxP-Richtlinien schreiben vor, dass der Bereich qualifiziert, die Temperatur überwacht und die Überwachungsgeräte zur Einhaltung der Richtlinien kalibriert werden müssen.
Qualifiziert: Die Qualifikation des Bereichs ist ein Prozess, in dem nachgewiesen wird, dass der Bereich die Anforderungen für seinen vorgesehenen Zweck erfüllt.
Überwacht: Die kritischen Kontrollparameter (unter anderem die Temperatur) werden gemessen und für die spätere Verwendung gespeichert (bisweilen bis zu 18 Jahre lang oder darüber hinaus).
Kalibriert: Die Geräte, die zu Überwachungszwecken eingesetzt werden, zeigen die korrekten Werte an. Die Geräte werden regelmässig kalibriert um zu gewährleisten, dass bei den Messungen immer korrekte Werte angezeigt werden.
Die Regeln geben nicht vor, wie die Bestimmungen erfüllt werden müssen, daher kann der Benutzer festlegen, wie der Bereich qualifiziert und überwacht werden soll und wie häufig die Geräte kalibriert werden sollen.
Arbeit mit den GXP-Richtlinien
Wenn ein Monitoringsystem installiert wird, müssen die erfassten Daten evaluiert werden, um zu gewährleisten, dass die Temperatur stets innerhalb der spezifizierten Grenzwerte liegt.
Beim Einsatz eines autarken Systems werden keine Live-Daten bereitgestellt, d. h. dass aufgetretene Temperaturabweichungen erst zu erkennen sind, wenn die Daten heruntergeladen werden.
Bei einem kontinuierlichen Monitoring-System wird der Benutzer per E-Mail, SMS oder Telefonanruf alarmiert, sobald ein Grenzwert überschritten wird, und kann dementsprechend handeln oder reagieren. Dabei weiss er genau, wo der Alarm aufgetreten ist, wann er begonnen hat, wie lange er bereits besteht und wer ihn gesehen hat.
Der Audit-Trail des kontinuierlichen Monitoring-Systems ermöglicht den Benutzern und Prüfern, einen Bereich zu verfolgen und dabei genau zu erkennen, was passiert ist und wann alle Benutzerinformationen in das System aufgenommen wurden. Dabei wird vermerkt, welche Standardarbeitsanweisungen (SOP) ausgeführt wurden und welche Korrektur- und Präventivmassnahmen erforderlich sind.
Eine Temperaturabweichung bedeutet in jedem Fall, dass etwas unternommen werden muss!
Verstösse
Wird ein Audit ausgeführt und werden dabei die regulatorischen Anforderungen nicht erfüllt, wird ein Verstoss dokumentiert. Das FDA-Formular 483 „Benachrichtigung über Anmerkungen zu einer Inspektion“ beinhaltet einen dokumentierten Verstoss nach einem FDA-Audit. Sobald einem Unternehmen das Formular 483 zugestellt wurde, sind die Daten öffentlich verfügbar. Im Jahr 2019 wurden über 155 Mängel bei der Umgebungüberwachung (hauptsächlich in Bezug auf die Temperatur) in den Bereichen Arzneimittel, Medizinprodukte, menschliche Gewebetransplantate, Veterinärmedizin und biologische Präparate festgestellt und dokumentiert.

Kontrollierte Umgebungen
Wesentlicher Bestandteil bei der Planung einer Anlage ist das Design des Gebäude-Managementsystems (BMS). Das BMS verwaltet viele Funktionen in einer Anlage, darunter Heizung, Lüftung und Klimaanlage (HLK) des Gebäudes, mit Hilfe von Sensoren, die über die gesamte Anlage verteilt sind. Um zu gewährleisten, dass das BMS das HLK-System korrekt steuert, kann ein Umgebungs-Monitoringsystem (EMS) installiert werden. Das EMS überwacht alle im Rahmen der Produkt-Risikobetrachtung definierten kritischen Kontrollparameter, die während der Anlagenqualifikation definiert wurden. 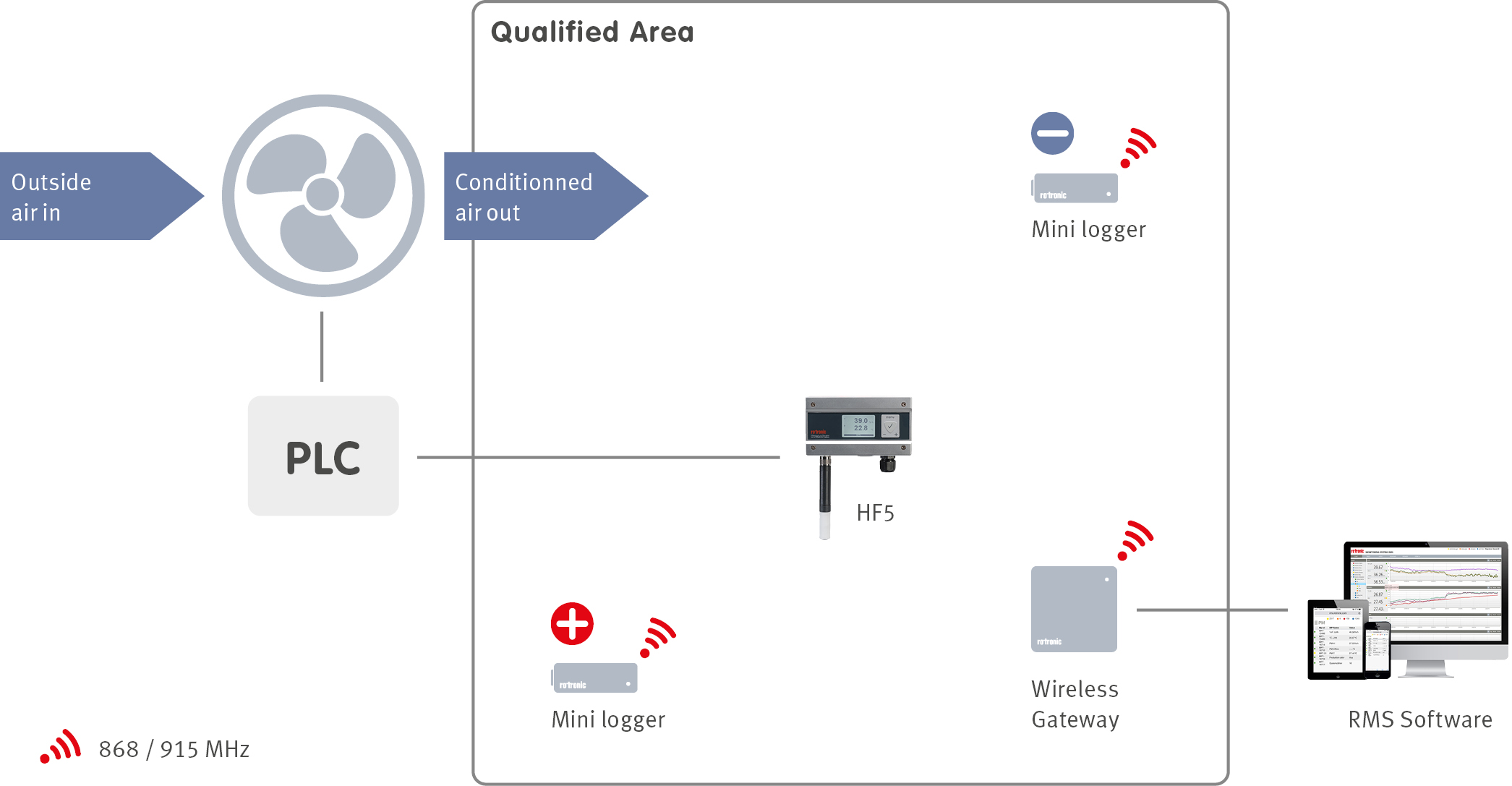
Auch in kontrollierten Umgebungen in der F&E-Phase sowie bei Transport- und Lageranwendungen wird die Temperatur kontrolliert. Das Monitoring ist zudem erforderlich um zu gewährleisten, dass die Temperaturkontrolle korrekt durchgeführt wird!
Qualifikationen des Bereichs
Die Qualifikation des Bereichs soll anhand von wissenschaftlichen Nachweisen belegen, dass der Bereich für den vorgesehenen Zweck geeignet ist.
Die Anforderungen für Verpackung und Lagerung USP 659 beinhalten Definitionen für Lagerbedingungen im Hinblick auf die Lagerung und Verteilung von Wirkstoffen, Hilfsstoffen und Medizinprodukten sowie Arzneimitteln, Geräten, Kombinationsprodukten und Nahrungsergänzungsmitteln. Für alle Produkte sollten spezifische Anweisungen in Bezug auf die Lagerbedingungen (Temperatur oder Feuchte), bei der ein Artikel gelagert und versandt werden muss (basierend auf Stabilitätsstudien), vorgegeben werden.
Für die Temperatur und Lagerung von Arzneimitteln gelten folgende Definitionen:
- Gefrierkammer: -25…-10°C.
- Kühlschrank: 2…8°C.
- Kalt: 8°C
- Kühl: 8…15°C.
- Raumtemperatur: Die in einem Arbeitsumfeld herrschende Temperatur.
- Kontrollierte Raumtemperatur: 20…25°C. Die mittlere kinetische Temperatur sollte 25°C nicht übersteigen, Abweichungen zwischen 15 und 30°C sind jedoch zulässig, vorübergehende Spitzen bis 40°C sind zulässig, sofern sie eine Dauer von 24 Stunden nicht überschreiten. Spitzen über 40°C können zulässig sein, wenn der Hersteller dies zulässt.
- Was bedeutet mittlere kinetische Temperatur?
- Warm: 30…40°C.
- Übermässige Hitze: >40°C.
- Trockener Ort: durchschnittliche relative Feuchte >40 % bei 20°.
- Vor Frost schützen.
- Vor Licht schützen.
Was bedeutet mittlere kinetische Temperatur?
Die mittlere kinetische Temperatur ist die Gesamteinwirkung der Temperatur auf einen Gegenstand oder ein Produkt über eine gewisse Zeit.
Auszug aus ICH Topic Q 1 A (R2): Stabilitätsprüfung von neuen Arzneimitteln und Produkten:
Mittlere kinetische Temperatur: Eine einzelne Temperaturabweichung, die - falls sie über einen bestimmten Zeitraum aufrecht erhalten wird - die gleiche thermische Herausforderung darstellt, wie Temperaturschwankungen nach oben und unten über einen äquivalenten definierten Zeitraum. Die mittlere kinetische Temperatur ist höher als die arithmetische Durchschnittstemperatur und berücksichtigt zudem die Arrhenius-Gleichung.
Sobald die Anwendung des Bereichs definiert wurde, wird ein Temperatur-Mapping durchgeführt, um sicherzustellen, dass der gesamte Raum innerhalb des festgelegten Temperaturbereichs kontrolliert wird. Bei diesem Mapping werden die heissen und kalten Stellen innerhalb des Bereichs definiert, die anschliessend überwacht werden müssen.
Im WHO-Supplement 8 „Temperatur-Mapping von Lagerbereichen“ wird erläutert, wie ein systematisches Mapping-Verfahren in Bereichen mit kontrollierter Temperatur ausgeführt wird.
USP 1079 beinhaltet ebenfalls Richtlinien zum Temperatur-Mapping.
Rotronic bietet Geräte zum Mapping sowie Mietausrüstung und komplette Mapping-Dienstleistungen.
Installation eines Monitoring-Systems
Die Risikoanalyse dient der Definition, welche Art von Monitoring-System erforderlich ist. Zu diesem Zweck hat die ISPE den GAMP5-Leitfaden „Konforme GxP-computergestützte Systeme“ herausgegeben, der regulierte Benutzer sowie Lieferanten dabei unterstützen soll, eine geeignete Lösung zur Einhaltung der GxP-Bestimmungen bereitzustellen.
Rotronic bietet die folgenden elektronischen Datenlogger zu Monitoring-Zwecken:
- HL-1D (autarkes Monitoring)
- HL-20D (autarkes Monitoring)
- RMS-MLOG (kontinuierliches Monitoring per Funk)
- RMS-LOG (Funk- und kabelgebundenes kontinuierliches Monitoring)
Erfolgt das Monitoring digital, sollte das Monitoring-System die Bestimmungen aus FDA 21 CFR Part 11 und EU Annex 11 erfüllen.
Rotronic bietet die folgenden Software-Lösungen der GAMP5-Kategorie 4, die den Bestimmungen für Monitoring-Anwendungen entsprechen:
- HW4 (autarkes Monitoring)).
- RMS (kontinuierliches Monitoring)
RMS Advantages at a glance
1) FDA 21 CFR Part 11/EU Anhang 11-konform & auf der Grundlage der GAMP5-Richtlinien konzipiert.
2) Kontinuierliches Monitoring.
3) Alarm per E-Mail, SMS und Telefon.
4) Einfach und schnell einsatzbereit.
Das (autarke oder kontinuierliche) Monitoring-System muss validiert werden, um zu gewährleisten, dass es basierend auf dem risikobasierten Ansatz entsprechend den GAMP5-Empfehlungen für konforme GxP-computergestützte Systeme für den vorgesehenen Zweck geeignet ist.
Geräteauswahl
USP 1118 „Monitoring-Geräte – Zeit, Temperatur und Feuchte“ bietet einen Überblick über die Messgeräte, die eingesetzt werden können, und erläutert die verschiedenen Technologien.
Rotronic setzt die folgenden Technologien für Funk- oder kabelgebundene elektronische Datenlogger ein:
Temperatursensoren:
Relative Feuchtesensoren:
Geräte-Kalibrierung
Die Rotronic Geräte können über das Geräte-Display oder in der entsprechenden Software kalibriert werden. Rotronic bietet eine Reihe von Kalibriergeräten für Temperatur und relative Feuchte:
- EAxx-SCS-Salzlösungen (Lieferung mit einem ISO-17025-Kalibrierzertifikat)
- HygroCal100 humidity generator
- HG2-S Feuchte- und Temperaturgenerator
- HG2-XL Feuchte und Temperaturgenerator
- S8000 Taupunktspiegel-Referenzgerät
RMS bietet ein Tool zum Kalibriermanagement, in dem alle Kalibrierverläufe dokumentiert werden und das die Anwender an anstehende Kalibrierungen erinnert. Rotronic bietet zudem Kalibrier-Dienstleistungen:
- Kalibrierungen vor Ort.
- ISO 9001-Kalibrierungen.
- ISO 17025-Kalibrierungen.
Schulung
Rotronic bietet Hardware- und Software-Schulungen, um zu gewährleisten, dass die Benutzer unsere Lösungen für GxP-Anwendungen in vollem Umfang nutzen können.
Dienstleistungen
Rotronic unterstützt seine Kunden mit den folgenden Leistungen
Fragen? Wir beraten Sie gerne persönlich!
Empfohlene Produkte
-
WB-0001
Der WB-0001 erfasst das Vorhandensein von Wasser oder leitfähigen Flüssigkeiten, sobald ein Füllstand erreicht wird, der zwei Leiterbahnen auf dem Gehäuseboden überbrückt.
Learn More -
RMS-MLOG-B-915 - Mini-Funkdatenlogger - Temperatur & Feuchte
Klein, preiswert und flexibel
Learn More -
RMS-MLOG-BT-915 - Mini-Funkdatenlogger - Temperatur & Feuchte
Klein, preiswert und flexibel
Learn More -
RMS-LOG-T30-868
Der RMS-LOG-T30 ist ein Datenlogger mit zwei integrierten Analog-Digital-Wandlern, an welche zwei PT100-Sensoren für die hochgenaue Temperaturmessung angeschlossen werden können.
Learn More -
RMS-LOG-T30-915
Der RMS-LOG-T30 ist ein Datenlogger mit zwei integrierten Analog-Digital-Wandlern, an welche zwei PT100-Sensoren für die hochgenaue Temperaturmessung angeschlossen werden können.
Learn More -
RMS-LOG-T30-L - Datenlogger
Der RMS-LOG-T30 ist ein Datenlogger mit zwei integrierten Analog-Digital-Wandlern, an welche zwei PT100-Sensoren für die hochgenaue Temperaturmessung angeschlossen werden können.
Learn More -
AC1207
Für aktive Adapter-und Konverterkabel Netzadapter RNG 11, 9V/ 200 mA, 3,5 mm Klinkenstecker, Spitze + Learn More -
RMS T10-0113
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0013
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0006
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0005
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0004
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0003
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0002
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS T10-0001
Die T10-Temperatursensoren sind NTC-Thermistoren (NTC = Negativer Temperaturkoeffizient); das bedeutet, dass der NTC-Widerstand bei steigender Temperatur abnimmt.
Learn More -
RMS-MLOG-T10-868 - Mini-Funkdatenlogger - Temperatur mit externem Fühler (NTC)
Klein, preiswert und flexibel
Learn More -
RMS-MLOG-T10-915 - Mini-Funkdatenlogger - Temperatur mit externem Fühler (NTC)
Klein, preiswert und flexibel
Learn More -
RMS-MLOG-T-868 - Mini-Funkdatenlogger - Temperatur
Klein, preiswert und flexibel
Learn More






















